關于靶向藥物的研發(fā)�,其難點不僅在于選取疾病相關信號通路中的目標蛋白,更在于針對目標蛋白在生理環(huán)境下的構象變化過程中選取適宜的分子構象�,并找到有效的結合位點設計具有針對性的藥物分子結構。對于新靶點的探索中,藥學家與生物學家往往需要綜合應用多種實驗手段���,從不同的角度與方向探索相應靶點蛋白的分子結構特征與生物學機理����,從而篩選并設計相應的藥物分子�����。?
近年來��,隨著計算機藥物設計技術硬件水平的高速發(fā)展和算法的優(yōu)化��,AI在藥物研發(fā)管線的諸多流程環(huán)節(jié)中�,從數年前的邊緣輔助角色逐漸轉變?yōu)橹饕巧Y合了結構生物學及分子動力學運算工具的方法流程�����,逐漸在針對全新靶點的藥物發(fā)現領域發(fā)揮出至關重要的推動力��。
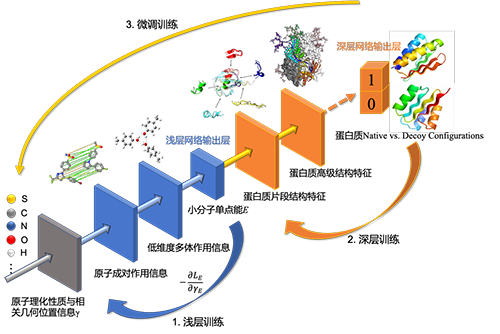
利用量子力學計算獲得對于小分子片段數據庫的高精度能量數據,結合分子動力學模擬對大分子體系的自由能面進行多層學習�,建立基于人工智能模型的分子模擬及自由能分析算法。
蘇州予路乾行生物科技有限公司(以下簡稱:予路乾行)即定位于一家以分子模擬與建模技術驅動新藥研發(fā)的技術型企業(yè)����,它于2021年由鄭錚博士創(chuàng)辦。后者長年專注于與人工智能算法相結合的分子動力學模擬研究�����,所主導開發(fā)軟件產品Movable Type Package為包括美國德州大學MD Anderson癌癥中心���、葛蘭素史克公司���、DeepCure研究機構與生物醫(yī)藥企業(yè)廣泛使用。
予路乾行的研發(fā)思路是將人工智能算法與大規(guī)模分子動力學模擬技術(Large-Scale Molecular Dynamics)相結合��,通過大量學習分子的動力學特征及自由能面的映射關系�,結合基于機器學習的分子力場模型(Machine Learning-based Force Field)對復雜大分子進行高效模擬,從而精確還原靶點蛋白在生理過程中的構象變化并在動態(tài)結構模擬中捕捉與其功能相關的關鍵結合位點進行藥物篩選及結構優(yōu)化����。
而采用AI技術結合分子動態(tài)模擬的運算流程,可以彌補傳統(tǒng)的AI藥物設計算法中大量依賴分子的單一構象形態(tài)特征或更為抽象的基因/氨基酸序列特征造成的信息缺失。

靶點蛋白質分子構象隨生理過程發(fā)生形態(tài)變化�����,利用分子構象變化過程中呈現出的不同優(yōu)勢構象進行藥物分子設計�,是靶向藥物研發(fā)的新方向��。圖中顯示的是6-磷酸果糖激酶-2/2,6-二磷酸果糖磷酸酶3蛋白(PFKFB3)中兩個重要的氨基酸殘基在500?納秒時間尺度上發(fā)生的顯著構象改變����。PFKFB3是糖酵解通路中的上游蛋白,與腫瘤細胞的快速增殖息息相關����。??
發(fā)展到現在,予路乾行正在推進與國內外多家藥企及生物科技公司的藥物共同研發(fā)項目�����,目前已有7條在研合作管線推進中�����。
其中值得關注的是���,予路乾行在與北京鞍石生物科技有限責任公司的合作中�����,通過采用高精度分子模擬技術���,從動力學及熱力學兩方面對藥物的體外活性及代謝過程進行全面評估,在一年內即助推一款針對非小細胞肺癌的靶向藥物進入了臨床試驗階段�,更與臨床試驗所在醫(yī)院相關團隊共同探索該試驗性藥物在更廣泛的突變靶點類型中的推廣可能性。
另外�����,從今年開始���,予路乾行還與南京瑞初醫(yī)藥有限公司展開合作��,雙方就3款CNS類藥物的從頭研發(fā)項目簽訂了總金額達數千萬元的合作協(xié)議��,目前已取得了初步成果����。?據悉,予路乾行目前已初步完成在國際化市場拓展及公司核心研發(fā)團隊資源儲備����,這將為公司在融入國際新藥研發(fā)體系及國內外市場拓展等方面奠定基礎。